- Napište nám
- Kontakty
- Reklama
- VOP
- Osobní údaje
- Nastavení soukromí
- Cookies
- AV služby
- Kariéra
- Předplatné MF DNES
K čemu se hodí … indium?
Indium je těžký, lesklý a hlavně měkký kov. Je dokonce měkčí než olovo. Podobá se tak trochu plastelíně, protože se dá zpracovávat dokonce i pouhou rukou. Můžete ho hníst, roztlačit ho na tenkou placku nebo krájet nožem.
Má ještě jednu zajímavou vlastnost – jako kov má extrémně nízký bod tání, rozhodně daleko nižší než olovo nebo cín, jeho chemičtí příbuzní. Indium taje při pouhých 157 °C. Bod varu už odpovídá naším představám o „opravdovém“ kovu a činí 2000 °C.
Indium je dnes považováno za kov, který při nynějším tempu spotřeby vypotřebujeme ze všech nejdříve. Využíváme ho totiž v oněch skvělých komunikačních vynálezech, které nám zpříjemňují život a bez kterých si všední den snad už ani nedokážeme představit.
Jak a kde se rodí indium?
Indium vzniká (podobně jako ostatní těžké prvky) při výbuchu supernov nebo ve hvězdách, kterým říkáme rudí obři.
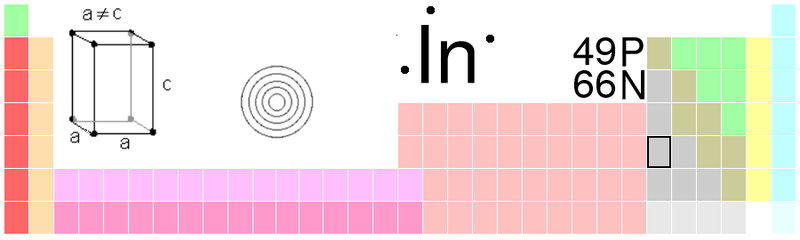
Pomocí r-procesů (název pochází od slova „rapid“) nebo s-procesů (název je odvozen od slově „slow“) se tak tvoří dva hlavní izotopy, In-113 a In-115. Oba mají v jádře 49 protonů, liší se jen počtem neutronů. Izotop In-115 je radioaktivní. Má ale tak dlouhý poločas rozpadu (440 biliónu roků), že se dá jeho aktivita zanedbat. Každou vteřinu v kilogramu india probíhá zhruba 250 beta-rozpadů, při kterých se uvolňují elektrony
Přírodní poměr obou vzniklých izotopů je 95,71 : 4,29 ve prospěch In-115. To je netypické, protože se tak indium skládá z většího množství radioaktivního izotopu, než jeho neradioaktivní formy. U atomových jader, která mají méně než 82 protonů, se s tímto jevem setkáme jen u india a u rhenia.
Pomalý proces se charakterizuje záchytem neutronu jádrem kadmia.
112Cd + n › 113In + ß- + 6,89 MeV nebo 114Cd + n › 115In + ß- + 7,59 MeV
Na rychlém procesu se podílí větší množství neutronů, které se zachytí v rychlém sledu v jádře železa, které je posledním stupněm jaderné syntézy v centru velice těžkých hvězd.
56Fe + 59n › 115In + 23ß- + 505 MeV nebo 56Fe + 57n › 113In + 23ß- + 489 MeV
Výskyt india na Zemi a ve vesmíru
Ve vesmíru je india jen velice málo. Průměrně se v něm nachází 300 nanogramů india v jednom kilogramu hmoty. V materiálu naší mateřské planety ho je poněkud více, 3 mikrogramy na kilogram. Samotná zemská kůra obsahuje až 250 mikrogramů na kilogram.
Indium tvoří minerál indit (sulfid s chemickým vzorcem FeIn2S4) a roquésit (CuInS2). Převážná většina india se na Zemi nachází jako příměs v cínových a olovnatých rudách, ve kterých se vyskytuje v podobě sulfidů.
Objev a jméno kovu
Indium objevili Ferdinand Reich a Theodor Hieronymus Richter v roce 1863 v německém Freibergu. Indium nedostalo svůj název podle státu Indie, jak by se mohlo zdát, ale podle pozorované spektrální linie v modré části viditelného spektra (tzv. indigově modré spektrální linii).
Odkud pochází naše indium?
Největším producentem a zároveň i největším spotřebitelem india je Čína. Vyrábí se v ní více než polovina dnešní produkce. Zbytek připadá na Japonsko, Kanadu, Jižní Koreu, Belgii, Rusko a Peru.
Jelikož se indium nachází ve formě minerálů jen zřídka, je většina tohoto zajímavého kovu získávána jako vedlejší produkt při výrobě zinku a olova.
Vzácnost přírodních nalezišť způsobila, že se indium vyplatí získávat recyklací z použité elektroniky. Od roku 2008 je dokonce množství takto vyrobeného india větší, než množství, které se těží v přírodě.
K čemu je dobré indium?
Indium samo o sobě by bylo všestranným kovem, které by mohlo najít různá využití – nebýt jeho vzácnosti. Dnes se používá v podstatě jen tam, kde se díky svým speciálním vlastnostem nedaří jeho záměna za jiné kovy.
Jeho velice nízký bod tání ho předurčuje k tomu, aby se stalo součástí letovacích slitin. Nízkou teplotu tání využívají také detektory požárů.
Výborná kujnost a kluzkost india se dá použít u různých olověných nebo ocelových součástek. Jako ochrana povrchu proti otěru. Tenká ochranná vrstva india se na ně nanáší galvanickou cestou.
Indium v teploměrech
Indiová slitina se používá jako plnivo vysokoteplotních teploměrů. Také v běžných teploměrech, se kterými si měříte teplotu, může nahrazovat toxickou a zdraví nebezpečnou rtuť slitina india s cínem a galiem, která je známá pod komerčním jménem galinstan. Taje při 19,5°C.
Indium ve vaší elektronice
Největší a nejdůležitější roli dnes indium hraje v elektrotechnice. Jsou to například infračervené senzory, nebo solární kolektory, které se bez neobejdou sloučenin india.
Velkou roli hraje v elektrotechnice smíšený oxid cínu a india, (anglicky indium tin oxide, ITO). Vyznačuje se tím, že je průhledný a dobře vede elektrický proud.
Dají se z něho tvořit průhledné spoje v solárních bateriích nebo se dá použít v displejích z tekutých krystalů a CCD senzorech fotokamer. Nově se tento oxid využívá v displejích s technologií organických elektroluminiscenčních diod (OLED) například v mobilních telefonech a v dotykových obrazovkách.
Smíšený oxid cínu a india má ale také jinou zajímavou vlastnost. Je nejen průhledný ve viditelné části spektra, zároveň také odráží tepelné paprsky. Může se tedy použít jako ochranná vrstva ve sklech, chránících proti tepelnému záření.
Atomární indium (tedy indium v čisté, kovové formě) se používá k dotování jiných dvou prvků, křemíku a germania. Umožňuje tak například výrobu diod do usměrňovačů. Protože elektronické obvody různých přístrojů potřebují ke své činnosti stejnosměrný proud a k distribuci elektrické energie se využívá proud střídavý, bývají tzv. usměrňovače součástí většiny elektrických přístrojů a zařízení spotřební elektroniky, napájených z elektrické sítě. Indium naleznete také v různých polovodičích, které se používají při výrobě tranzistorů, fotovoltaických článků, diod, aj.
Světlo a video
Jako by nebylo pole využití india už dost široké, stalo se v posledních letech navíc ještě prvkem, který nám dovoluje svítit s vynaložením jen zlomku energie, která byla k tomuto úkonu potřeba v minulých desetiletích.
K výrobě některých LED (světlo emitujících diod) se totiž využívá sloučenina s chemickým vzorcem InGaN (smíšený indiumgaliumnitrit). Takové diody vyzařují světlo, jehož barva a vlnová délka závisí na přesném chemickém složení diody. Může být od ultrafialového až po zelené.
Takové diody se používají nejen ke svícení, využívají se také ke čtení nebo psaní informace v blueray discích.
Pokud bychom měli vybrat z chemických prvků ten, který nám nejvíce zpříjemňuje komunikaci a volný čas, bylo by to nejspíš právě indium. Zároveň se indium stává vysoce nedostatkovým zbožím. Jeho přírodní zdroje se rychle vyčerpávají. O to důležitější je recyklace starších a už nepoužívaných obrazovek nebo mobilních telefonů. Přesto nebude jednoho, nejspíš příliš blízkého, dne nabídka stačit poptávce. Recyklovat se totiž dají jen ty přístroje, které byly vyrobeny. Ani tyto zdroje india nejsou nevyčerpatelné.
Dana Tenzler
Bludná planeta - první kandidát na osamělou planetu podobnou Zemi

| Další články autora |
Střední školy
Nepřehlédněte
- Langšádlová končí jako ministryně pro vědu a výzkum. Nahradit ji může Havel
- Zámek Štiřín bude na prodej, o areál nemá zájem žádná státní instituce
- Novým majitelem Zbrojovky Brno se stal hokejový boss Libor Zábranský
- Hvězdy NHL ozáří MS v Česku. Přijedou Bedard, Karlsson, Tkachuk i Hischier
- Muž se nadýchal chemikálie, která unikla z tlakové lahve. Patrně jde o chlor
- Zastal se urážené kamarádky, schytal kopanec do hlavy. Policie hledá útočníka
- „Není podstatné být vidět, ale mít výsledky.“ Politici reagují na konec ministryně
- Macháč je na tenisovém turnaji v Madridu ve druhém kole. Čeká ho Shelton